|
各癌种临床研究的进程存在共通和迥异,源于生物学特性的差异。打破癌种的界限、跨学科综合评价不同癌种在同一治疗模式下的内在规律和关键节点,有利于启发我们根据肿瘤的发生、发展特点及其治疗特征探索最佳治疗模式,为不同学科的肿瘤临床研究和实践提供相互借鉴和启发的平台。
新辅助治疗在肿瘤的临床实践和研究探索中备受关注,各领域临床试验相继开展,CSCO 青委在该领域进行了跨癌肿的探索和讨论,围绕同一个问题,分享各自的经验。 分论 1、头颈部鳞癌 头颈部鳞癌的特殊解剖结构决定了其器官功能保留的重要性。由于头颈部鳞癌治疗失败模式主要是局部复发而非远处转移,患者对术后辅助化疗耐受性较差,术后辅助化疗作用有限。幸运的是,头颈部鳞癌对化疗敏感性较高且化放疗存在协同作用,奠定了新辅助化疗在检验肿瘤生物学特性、制定术后局部治疗方案等方面的基础。 RTOG 91-11 研究 [1] 入组 547 例局部晚期喉癌患者(去除侵犯甲状软骨或舌根超过 1cm 的 T4 期,因此类患者从放疗的获益有限),随机分组至同期放化疗加顺铂增敏组、新辅助序贯化放疗组和单纯放疗组,2 年保喉率分别为 88%、75%、70%,2 年局控率分别为 80%、64%、58%;而长期随访数据显示,三组的 5 年保喉率差别显著(83.6%、70.8%、65.8%),但 5 年 OS 无差别(55.1%、58.1%、53.8%)。 虽然 2006 年的 ASCO 指南推荐同期化放疗作为局部晚期喉癌的器官保留手段,但仍需严格把握适应症、避免过度治疗。Machtay 等 [2] 分析了 3 项 RTOG 研究,结果显示同期放化疗导致了 43% 的严重远期毒性,其中 28% 的咽喉部功能障碍及 13% 的鼻饲管依赖,说明较高的保喉率并未实现器官功能的保留。 针对局部晚期下咽癌的 EORTC 24891 研究 [3],因考虑到下咽癌治疗失败的模式有局部复发和远处转移,故严格限制仅达到完全缓解的患者接受根治性放疗,其 3 年器官保留率 42%,但两组的 3 年生存率、5 年总生存率均无明显差别(分别为 57% vs 43%、 38.0% vs 32.6%),远处转移率亦无统计学差异(28.0% vs 36.2%)。上述两项研究表明,不能为了追求器官保留而忽略了器官功能保留,更需重视患者的长期生存获益。 2009 年,Yoann Pointreau 等 [4] 对比了 TPF 和 PF 方案在局部晚期喉癌和下咽癌患者中的疗效,初步证明了 TPF 强化方案可以提高器官保留率,但并未优于同期放化疗,亦未转换为生存的改善。强化化疗联合放疗所导致的远期毒性再次使研究者们思考是否考虑加用靶向药物降低毒性、同时保留器官功能、提高生存? 2013 年 TREMPLIN 研究 [5] 入组局部晚期喉癌和下咽癌患者,接受 3 周期 TPF 方案后随机分组至放疗联合西妥昔单抗组或放疗联合顺铂组,两组的保喉率和喉功能保留率无明显差别(分别为 93% vs 95%、82% vs 87%),3 年总生存也未见差异(73% vs 75%);但是西妥昔单抗组的耐受性和安全性方面具有明显优势,是否能够明显改善生存尚无定论。总体来看,头颈部鳞癌新辅助放化疗模式的重点在于筛选适宜人群,以最大限度达到器官功能保留和生存延长。 |
|
|
1#
发布于:2014-11-18 18:34
2、骨肉瘤
骨肉瘤分型复杂,高度恶性,目前标准治疗方案是“新辅助化疗——手术——辅助化疗”。其中新辅助化疗可增加保肢率、改善患者生活质量,同时降低复发风险,但研究 [6] 表明新辅助化疗并不能在辅助化疗的基础上进一步延长生存。是否能够通过改善化疗方案来增加生存获益? Goorin 等 [7] 的研究认为 IFO 联合 VP-16 可作为术前诱导化疗方案,然而 Zalupski 等 [8] 发现联用 IFO 并未在原有的化疗方案基础上改善生存。Marina 等 [9] 进行了一项迄今为止有关骨肉瘤最大的临床试验,通过评估肿瘤坏死率决定术后 MAP+ 干扰素维持治疗或 MAP+IFO 治疗;最终数据分析值得期待。 除了给药方案的不同,给药剂量和途径的改变是否能够改善生存?2014 年, meta 分析 [10] 提示剂量增加不能改善患者的 5 年 DFS、OS,但在一定程度上可降低局部复发风险、提高组织学应答率。组织学反应主要体现在肿瘤细胞坏死率(TNR)上,最常使用的评价系统是 Huvos 系统,目前的临床研究多将 TNR>90% 认为肿瘤组织学反应良好。 但 Lewis 等学者 [11] 的研究发现新辅助化疗后即使达到了良好的 TNR,但是患者的 DFS、OS 并未获益;由此质疑 TNR 作为新辅助化疗疗效评估的替代指标。而 Xin Li 等 [12] 认为,若 90% 作为 TNR 评价疗效指标,无法准确评估患者的生存获益;建议将 TNR 分界值定在 70%。 目前骨肉瘤的新辅助化疗和辅助化疗可使患者达到 60-70% 的无病生存率,但疗效似乎已到平台期。随着分子靶向研究的开展,针对骨肉瘤的治疗需要开发新的分子靶向药物及免疫治疗药物,在生物标志物的指导下筛选获益人群,进一步提高患者的总体生存。 |
|
|
2#
发布于:2014-11-18 18:37
3、乳腺癌
目前尚无证据明确新辅助治疗在乳腺癌患者中的价值。故乳腺癌新辅助治疗的探索主要在于如何通过不同的治疗方案和疗程提高疗效、改善生存。Liedtke 等 [13] 发现三阴性乳腺癌(TNBC)患者的 pCR 率高于非三阴性患者(22% vs 11%),但其 3 年 DFS、OS 偏低;而在 pCR 患者的总生存优于非 pCR 者。 GeparTrio 研究 [14-16] 根据 2 个疗程 TAC 后的不同疗效,将 CR/PR 者随机分组再行 4-6 疗程的 TAC 治疗,SD 患者随机分组至 4 疗程 NX 方案或 4 疗程 TAC 方案,结果提示组内的 pCR 率无差异,但 TAC 8 疗程的患者其 DFS、OS 有延长趋势,接受 NX 方案 4 疗程的患者其 DFS 有显著延长。由此可见,不同分子分型的患者对相同治疗方案的 pCR 率不同;同一分子分型的患者对不同化疗方案的 pCR 率也有不同;而同一分子分型的患者接受相同化疗方案后根据疗效引导调整方案,可以改善 DFS 和 OS。 靶向药物在新辅助治疗中又起着怎样的作用呢?在同为 HER2+ 的局部晚期乳腺癌(LABC)中 [17],P-FEC+H 组的 pCR 率显著高于 P-FEC 组(66.7% vs 25%,p=0.02),证实了靶向治疗在 HER2+ LABC 患者中的重要作用。Soley Bayraktar 等[18] 进一步回顾性分析了靶向药物联合不同化疗方案在 HER2+ LABC 患者中的不同疗效,结果提示 PH-FECH 组较 TCH 组有更高的 pCR 率(60.6% vs 43.3%,p=0.016),且有效转化为 3 年无复发生存(RFS)(93% vs 71%)、3 年总生存(96% vs 86%)的获益。 而 ML22770 研究探索了靶向药物联合相同化疗方案在不同给药间隔情况下对 pCR 的影响,初步数据显示 wPCH 方案的 pCR 率高于 3wPCH 方案,但生存数据尚未报告。由此可见,是否进行靶向治疗、靶向治疗联合不同化疗方案及不同时机均会对 pCR 率和生存有显著影响。 2014 年,GeparSixto 研究 [19] 发现在 TNBC 的新辅助化疗中,TA+ 靶向药物 + 卡铂组比不加卡铂组明显提高 pCR 率(53.2% vs 36.9%),但在 HER2+ 患者中,两组的 pCR 无显著差异。这一结果提示不同分子亚型的乳腺癌中是否存在相同的敏感指标、在治疗前便能有效预测 pCR 率? Makiko 等 [20] 对此进行了探索。结果提示,TNBC 和 HER2+ 乳腺癌比 HER2 阴性乳腺癌有较高的 pCR 率(32%,21%,7%);其中,肿瘤淋巴细胞浸润评分(tumor-infiltrating lymphocyte score, TIL score)较高和肿瘤细胞坏死率(tumor cell apoptosis score)较高的 TNBC 患者中,分别有 37% 和 47% 达到 pCR,HER2+ 乳腺癌患者中各有 30% 和 25% 达到 pCR,均远高于 HER2 阴性乳腺癌患者(13%、0%)。尽管该研究结果仅限于试验阶段,但它为如何在治疗前根据肿瘤病理学特性预测有效性及生存获益提供了良好的思路。 此外,Kenji Tamura 等在 2014 年 ASCO(Abstract 1017)报道了 CP-CEF 组在 TNBC 患者中的 pCR 率显著高于 P-CEF 组患者(61.2% vs 26.3%,p=0.003),通过再次检测 46 位患者的肿瘤标本发现,pCR 患者中有 45.0% 出现 EGFR 表达,CP-CEF 组中有 63.8% 出现 EGFR 表达,提示 EGFR 表达能够在治疗前预测 TNBC 对卡铂的敏感性。TIL 和 EGFR 表达,分别来自肿瘤间质和肿瘤组织,代表着完全不同的生物学特性,却均在一定程度上与 pCR 率相关;这使得我们不禁发问,什么是敏感性?pCR、DFS、OS 能体现敏感性的本质吗? 不同研究对 pCR 定义各有不同,严重影响了 pCR 对于生存获益的解读,von Minckwitz 等 [21] 总结了一项 TA 为基础的新辅助化疗方案的荟萃分析,将 pCR 统一定义为在乳腺和腋窝均未找到浸润和导管内癌残留。分析显示,pCR 与 TA 疗程、剂量、是否加入曲妥珠单抗等成正相关,但与曲妥珠单抗用药疗程无相关;且 pCR 在 HER2 阴性及 ER/PR 阳性的 LABC 中最低,不能代表该亚组人群的预后,而在 HER2+ 阳性患者中 pCR 不能有效转换为生存获益。 该研究结果再次证明肿瘤生物学行为在不同的分子分型、治疗方案下有所不同,我们尚需深入分析其内在规律、寻找敏感指标,为实现个体化治疗提供更多证据。 |
|
|
3#
发布于:2014-11-18 18:38
4、肺癌
2014 年,NSCLC Meta-analysis Collaborative Group 发表在 Lancet 上的一篇以 IPD(individual participant data)为基础的 meta 分析 [22] 最终确定了新辅助化疗对比单纯手术在可手术切除患者中的重要地位,5 年生存率绝对获益 5%,死亡风险显著降低 13%(HR= 0.87,95%CI= 0.78-0.96,p=0.007)。但新辅助化疗和辅助化疗孰优孰劣尚无定论。 国内启动的一项多中心研究 CSLC 0501 对比了多西他赛 + 卡铂(TC)方案用于 IB-IIIA 期 NSCLC 患者、在术前新辅助化疗和术后辅助化疗两组的疗效;新辅助化疗组的 3 周期化疗完成比例高于辅助化疗组(91.8% vs 82.6%),但完全手术切除率低于辅助化疗组(82.5% vs 91.1%),主要由于新辅助化疗组有 15.5% 的患者因肿瘤进展、化疗毒性、依从性差等未接受手术治疗。初步数据显示两组的 3 年 DFS 相近,OS 生存数据尚未达中位数。 既然新辅助化疗已达到平台期,那么新辅助靶向治疗是否能够提高生存获益呢?广东省肺癌研究所在 2008 年启动的 CSLC 0702 入组经病理证实的 IIIA-N2 期 NSCLC 患者;第一阶段各入组 12 例,EGFR 野生型患者接受 GC 新辅助化疗 3 疗程、EGFR 突变型患者接受 erlotinib 新辅助治疗 42 天后评价疗效,首要观察指标为新辅助治疗的客观有效率:疾病若无进展则进行手术,若进展则更换二线或联合化放疗。结果显示,总体缓解率为 42%,分别为 58.33%、25.00%;但 erlotinib 组的中位 PFS 为 6.9 个月(95% CI= 3.8-10.0),低于 GC 组的 9.0 个月(95% CI= 3.1-15.0)。 新辅助靶向治疗可以提高术前的缓解率,但未能转化为术后生存获益。故通过细化生物标记物指导的靶向人群、增加辅助治疗,CTONG 启动了一项多中心随机对照临床研究 CTONG 1103/ EMERGING,招募经病理证实的 IIIA-N2 期、EGFR 突变阳性的 NSCLC 患者,术前予 erlotinib 共 42 天或 GC 方案 2 疗程后评估疗效,若疾病未进展则行手术治疗并于术后分别予 erlotinib 口服 1 年或 GC 方案 2 疗程;终点指标为 PFS。该项研究目前正在入组中,将为 EGFR-TKI 新辅助提供高级别证据。 肺癌的新辅助治疗经历了“新辅助化疗优于单纯手术——新辅助化疗与辅助化疗效果相近——新辅助靶向治疗较新辅助化疗提高缓解率但无法转换为生存获益——探索新辅助靶向治疗的优化和全程管理”4 个阶段,体现着生物标志物指导的个体化精准治疗时代的到来。然而,一个贯穿始终的问题悬而未决:由于随访时间长、入组困难、入组窗窄,新辅助治疗临床试验的研究周期长达 10 余年才能得到较完整的生存数据,严重限制了新药物、新策略的发展和推广;那么,是否存在相应的替代终点指标以加速研究进程呢? 替代指标的选择首先要满足以下三个条件:定性反映总生存、有效反映新辅助治疗效果、与生存获益量化相关。Matthew 等综合评估了多项研究 [23],通过截取新辅助治疗后的肿瘤组织最大截面制作切片、分类计数并计算残留癌细胞平均百分比,将仅 0-10% 残留肿瘤细胞定义为主要病理缓解率(major pathological response)。 研究发现,平均每增加 1% 的残留肿瘤细胞将增加 1% 的死亡风险,获得病理完全缓解(pathological complete response, pCR)的患者有较高的 3 年生存率(100% vs 49%),这在一定程度上加快了研究的进程。然而,这些数据多基于小样本临床试验,缺乏 pCR 的统一定义,在不同分子亚型的肿瘤中意义未明,均限制了其广泛应用;仍需要大样本临床研究提供进一步证据。 |
|
|
4#
发布于:2014-11-24 15:40
5、胃癌
胃癌的新辅助化疗方案经历了“顺铂 +5-Fu——ECF——DCF——FLOT——联合靶向药物”,提示单纯增加药物种类和剂量不能提高 pCR 率,而对于有明确靶点的胃癌增加靶向药物可提高应答率且良好地预测预后。多项研究表明新辅助化疗多应用于局部晚期胃癌患者,以实现肿瘤降期、提高 R0 切除率,且作为体内良好的药敏试验、指导术后化疗。 那么,是否存在某些指标能够预测新辅助化疗的敏感性呢?Karen Becker 等 [24, 25] 根据肿瘤细胞坏死程度和退缩程度这一空间维度的指标评价新辅助化疗疗效,并提出达到完全应答(无残留癌细胞)、次全应答(未受损癌细胞残留<10%)、部分应答(未受损癌细胞残留 10-50%)可认为新辅助化疗有效。故即便更早期的胃癌患者接受新辅助化疗后不能明显延长生存,新辅助化疗也有利于筛选能够从术后化疗获益的人群。 那么,何时进行疗效评价才能最有效地反映肿瘤的应答率呢?若过早评价,可能误判疗效;若延迟评价,一旦治疗失败、疾病进展,患者将失去手术机会。Weber 等 [26] 在胃癌新辅助化疗前、2 周后、手术前共 3 个时间点进行 PET-CT 检查,记录肿瘤摄取 FDG 的变化;研究发现肿瘤组织应答率、病人生存与 SUV 值的降低密切相关,但与 SUV 绝对值无关。 Weber 随即进行了的一项临床研究 [27] 以新辅助化疗后第 2 周时的 SUV 下降值超过 35%(代谢缓解)作为评估阈值,达到者继续 12 周化疗及手术,未达到者立即进行手术。结果发现,49% 的患者达到代谢缓解;试验组中有 58% 的病人达到显著病理反应,而对照组的患者中无人达到;两组的无不良事件生存有明显差异(29.7 月 vs 14.1 月,p=0.002);2.3 年随访中,试验组的中位 OS 未达到,对照组的中位 OS 仅 25.8 个月。PET 提示 FDG 摄取下降显著,其病理缓解率也较高,预示患者的生存获益也最好。 然而,由于 PET 早期代谢无缓解并不代表肿瘤早期进展,而对化疗敏感性较低也并不代表此类患者预后差。这提示我们有些肿瘤对治疗的应答出现时间(time to response, TTR)较晚,单纯依靠早期评价并不能准确判断疗效,故需适当延长评价节点。由此可知,PET 早期评价的意义主要在于早期发现少数代谢增加的患者并及时予以有效治疗;但仍不可忽略 pCR 在敏感性评价中的重要地位。 由于新辅助化疗患者的 pCR 率增高,其远处转移控制率也有相应提高,但新辅助放疗患者即使出现 pCR,其远处转移的控制率也未见明显提高;这提示我们在标准手术治疗后仍以远处复发和播散为主要治疗失败模式的肿瘤,新辅助化疗后的 pCR 有更大的意义。 |
|
|
5#
发布于:2014-11-24 15:40
6、食管癌
由于食管癌术后胃容积减小,严重影响患者术后营养状况,不仅降低了患者对术后化疗的耐受性,也严格限制了术后放疗、化疗的剂量和疗程,患者难以从辅助治疗中获益。故食管癌新辅助治疗主要着重于新辅助放化疗和新辅助化疗。2011 年,Sjoquist 等 [28] 进行了一项 meta 分析;结果显示,新辅助化疗对比单纯手术、新辅助放化疗对比单纯手术、新辅助放化疗对比新辅助化疗均能降低死亡风险(HR 0.87,95% CI= 0.79-0.96,p=0.005)(HR 0.78,95% CI= 0.70-0.88,p<0.0001)(HR 0.88,95% CI= 0.76-1.01,p=0.07)。 这项 meta 分析为新辅助放化疗提供了充分的循证医学证据,但其所涉及的研究存在分期不准确、放化疗方案较传统、手术质量未监测统一等问题,限制了临床推广应用。 2012 年 van Hagen 等在 NEJM 上报道了一项 III 期随机对照研究 [29],发现新辅助放化疗组的 R0 切除率远高于单纯手术组(92% vs 69%,p<0.001),而新辅助放化疗组的患者中有 29% 达到 pCR;新辅助放化疗组的中位 OS 显著延长(49.4 个月 vs 24.0 个月),其总生存也获益更多(HR 0.657,95% CI= 0.495-0.871,p=0.003)。两组的术后并发症、围术期死亡率未见明显差异。此研究初步确立了新辅助放化疗在局部晚期食管腺癌中的首要地位;但由于食管鳞癌入组病例仅占 23%,统计效能较低。 我国食管癌 90% 以上为鳞癌, 2007 年国内开展了一项 III 期随机对照临床研究 [30] 对比新辅助放化疗和单纯手术在局部晚期食管鳞癌患者中的疗效。初步数据显示新辅助放化疗可显著提高 R0 切除率(96.0% vs 85.5%,p=0.015),且其 pCR 率可达 29.6%;两组的 1 年、2 年生存率暂无明显差异(85.6% vs 79.1%,75.5% vs 66.1%,p=0.207),两组的 1 年、2 年无瘤生存率亦无统计学差异(86.6% vs 70.9%,83.2% vs 61.8%,p=0.075)。 安全性方面,新辅助放化疗引起的毒性反应较多,但均可耐受;两组术后并发症的发生率相似,且均未出现围术期死亡。然而,Brendon Matthew 等在 2014 年 ASCO(Abstract 4071)上报道了一项对比新辅助放化疗和新辅助化疗疗效的研究,结果显示尽管新辅助放化疗组的 pCR 率显著高于新辅助化疗组(30% vs 6%,p<0.01),但二者的 3 年无病生存率(33% vs 39%,p=0.84)、3 年总生存率(54% vs 52%,p=0.36)未见统计学差异,且新辅助放化疗组的手术并发症发生率、围术期死亡率较高。 |
|
|
6#
发布于:2014-11-24 15:41
7、直肠癌
新辅助治疗已成为局部晚期直肠癌的标准治疗模式,但具体的治疗方案、疗效评估及术后治疗方案仍未有定论。2014 年 ASCO 报道了两项联用与不联用奥沙利铂对局部晚期直肠癌(LARC)的疗效。Claus Rodel 等报道的 CAO/ARO/AIO-04 研究,对照组行术前放疗联合 5-FU 增敏并术后 4 周期 5-FU,试验组在术前、术后加用奥沙利铂。结果显示两组的毒性、手术并发症、保肛率等无明显差异,试验组的 pCR 率显著高于对照组(17% vs 13%),3 年 DFS 率有显著差异(75.9% vs 71.2%,p=0.03),但两组的 OS 未见显著差异。 另一项研究 Hans-Joachim 等在 ASCO(Abstract 3501)报道了奥沙利铂在以卡培他滨为基础的化疗方案中的作用。研究入组 LARC 患者,对照组接受 5 周的术前放化疗及术后 6 周期的化疗,试验组在对照组基础上加用术前、术后奥沙利铂。结果显示,试验组的毒性反应增加,两组的保肛率和 pCR 率无明显差异,且 3 年 DFS(73.9% vs 74.5%)及 OS 未见统计学差异;但试验结果仍需待入组完成后的数据进一步解读。 以上两项研究的长期随访数据似乎说明了奥沙利铂能够降低患者局部复发风险,但是得益于新辅助还是辅助化疗应用尚未知。随着直肠癌分子生物指标的研究进展,贝伐珠单抗因能改善肿瘤内部核心乏氧区的血供而使之转化为相对富氧区、从而增加了放疗的敏感性,故在 LARC 新辅助治疗中的应用成为研究热点。Sadahhiro 等 [31] 报道的一项单臂临床试验提示,贝伐珠单抗可以提高 pCR 率(19.2%),且 71.2% 的患者达到病理降期;术后并发症发生率达 28.8%,未能明显提高肿瘤应答率。贝伐珠单抗的临床应用仍需要大样本的随机对照临床试验提供高级别证据。 对于接受新辅助放化疗的 LARC 患者,如何根据疗效决定术后辅助治疗并预测预后呢?Jean Francois 等 [32] 研究认为,新辅助化疗敏感的患者,其对后续治疗的应答率较高、生存获益也好。故需根据新辅助治疗后肿瘤退缩程度来制定术后辅助化疗方案。 |
|
|
7#
发布于:2014-11-24 15:42
总 结
通过以上分别概述不同癌肿在各自领域的临床研究最新进展,我们可以将新辅助化疗的治疗模式做以下归纳。 1、理论依据 首先,新辅助治疗可以降低肿瘤负荷、肿瘤降期,减轻肿瘤压迫的相关症状,改善器官功能的实现。同时提高 R0 切除率,实现外科切除的两个最大限度,即最大限度切除肿瘤、最大限度保留正常组织和器官功能。 其次,新辅助化疗可以尽早消灭亚临床潜在的远处微转移灶或隐匿于淋巴结中的肿瘤细胞,降低术后远处转移的发生率。同时也能够观察是否存在遗漏的远处转移灶、以使患者避免无意义的手术创伤 [33]。 第三,新辅助治疗时间点的特殊性使癌旁正常组织和肿瘤的脉管结构在局部治疗前仍然完整,有利于保持靶病灶局部较高的药物浓度。 第四,放化疗的联合增敏作用有利于在术前检验肿瘤的生物学行为,及时调整化疗方案(“疗效引导治疗策略”),是良好的“体内药物敏感试验”。 最后,患者的依从性和对药物的耐受性较好。 |
|
|
8#
发布于:2014-11-24 15:42
2、适宜人群
并非所有的患者均能够从新辅助化疗受益。已有大量临床试验资料证明,早期患者接受单纯手术治疗已经能够获得较长的无病生存和总生存。部分患者在新辅助化疗过程中出现疾病进展,最终导致错失手术机会。故需严格筛选新辅助化疗的适宜人群。 TNM 分期中的局部晚期肿瘤。准确分期需要借助多种检查手段。如胃癌易于发生腹腔内播散,因常规影像学检查手段较难发现,PET-CT 因胃癌对 FDG 的摄取率较低而应用价值受限 [34-36];腹腔镜由于可以发现腹腔转移灶和腹膜、网膜的微转移灶而逐渐受到重视 [37]。 对于临床需要根治性器官全切的肿瘤,新辅助化疗提高器官保留率。对于临床不可切除的肿瘤,新辅助化疗可减小后续放疗剂量和照射野,降低治疗相关毒性。但对于“可切除”、“不可切除”并没有明确、统一的标准和定义。故一些学科在探索新辅助治疗适应症的过程中开始通过综合评估、量化肿瘤复发的高危因素,根据制定的风险分级从而进行分层治疗。 如直肠癌新辅助治疗过程中主要根据术前 MRI 评估,除了关注 T、N 分期之外,增加了距肛距离、直肠系膜筋膜和肠壁外脉管侵犯情况等指标,分为极低危组、低危组、中危组、高危组,新辅助治疗在不同分组中的地位有所不同 [38]。更加精确而标准化的筛选条件不仅能够最大程度富集获益人群,也能够消除不同治疗中心的选择偏倚,为开展临床试验提供条件。 |
|
|
9#
发布于:2014-11-24 15:42
3、新辅助治疗方案
根据肿瘤生物学特性的不同和目前已知有效的治疗方案的不同,可以将不同部位的肿瘤大致分为以下两类,根据新辅助化疗的目的不同而考虑不同的侧重点。 第一类是以化疗为主要治疗模式的肿瘤,其关注点在于化疗药物的种类、剂量、疗程、给药途径和间隔,单药或联合化疗、是否需要联合靶向药物、是否需要联合放疗。考虑一些化疗药物是剂量强度显著相关性,根据其代谢特点合理选择化疗药物的给药途径、间隔、剂量等。在联合化疗药物、增强疗效的同时,注意避免毒性作用机制相同或相似的药物,以减少毒性的叠加甚至是协同增加。 第二类是以放疗为主要治疗模式的肿瘤,其关注点在于联合化疗减少放疗剂量和放射野、早期筛选对放疗敏感的病人并预测放疗效果和预后。 |
|
|
10#
发布于:2014-11-24 15:43
4、术前疗效评估
新辅助化疗完成后,应该如何判断肿瘤对其敏感性?目前使用较多的指标是否能够真正代表肿瘤敏感性,以及如何根据肿瘤敏感性预测预后,尚无定论。 4.1、病理缓解率 病理缓解率,尤其是 pCR,是目前应用最广泛的评价指标;那么如何考虑 pCR 的空间意义(即 TNR)和时间维度(评价节点)? pCR 一般是指所有靶病灶和非靶病灶均消失、全部病理淋巴结直径小于 10mm 且未出现新发病灶。肿瘤细胞坏死率大于 90% 可认为 pCR,而肿瘤退缩程度的分级,主要是参考胃癌的 Becker 标准和 PRSC(多因素组织病理预后评分)[24, 25, 50]。较多研究表明新辅助化疗后达到 pCR 的患者有 DFS 延长趋势,且预后较好;也有一些研究发现即便 pCR 率高、DFS 延长,但是 OS 并无明显获益。不同的治疗模式下、不同时间段、不同的部位,肿瘤的微环境及其导致的生物学行为也可能不尽相同。故 pCR 存在的意义主要是能够尽早筛选出对化疗敏感的肿瘤继续原方案治疗,而对于早期未能达到 pCR 的患者需要尽早考虑手术或更换化疗方案。 虽然病理学评估可以作为新辅助化疗疗效最可靠和直接依据,也能预示良好的生存,但是因其有滞后性,研究者需要选择合适的时机进行 pCR 的评估。一般研究者以术前化疗 2~3 个周期后进行第一次评估,也有研究在 1 个周期化疗后评估 pCR 率,在尽早获得肿瘤敏感性信息的同时,患者仅暴露于较低剂量的化疗,对后续治疗不会产生太大的影响。 在不同肿瘤的研究中,pCR 所提示的信息也有一定的差别。一些研究的结果显示 [51],新辅助化疗患者的预后似乎只与病理学完全缓解有关,而与其他病理学评效分级不存在等级相关的关系。若肿瘤未达到 pCR,对于化疗有抵抗力的肿瘤细胞未被识别又未被手术切除的话,这将成为疾病进展和复发的源头。但在非小细胞肺癌中的研究发现 [23],pCR 程度与总体生存密切相关,不同分级的病理缓解率,其总体生存的获益也有程度上的差别。 其次,原发灶的病理学肿瘤退缩可能并非独立预后因素,而可疑转移的淋巴结状态对 OS 而言,是独立预后因素 [52-54];转移淋巴结中的反应,如肿瘤细胞坏死,泡沫样组织细胞浸润及纤维化等类似肿瘤原发灶的退缩改变等,可能更能代表新辅助化疗药物对于隐匿肿瘤细胞的潜在杀伤作用,从而减少术后的复发几率。此外,新辅助化疗更易出现远处转移 [55],尤其是脑转移,可能主要是化疗药物不能通过血脑屏障,或非 pCR 患者更倾向于在血液循环中存在持续性微小转移,而其远处转移的能力相对较弱、不会以脑转移为首发灶。尚需更多研究探讨不同肿瘤的内在规律和各自不同的敏感性生物学指标。 4.2、多个 MRI 参数的综合评估 由于一些肿瘤的新辅助治疗尚无明确标记物的生物靶标指导下的治疗,故对其疗效的评估主要是依赖于对肿瘤负荷、新辅助治疗指征等临床参数的再细化。比如在直肠癌疗效的评估中多用 DWI 联合常规 MRI [56],高分辨成像序列的应用以判断磁共振的肿瘤退缩程度和环切缘 [57] 等,不仅能够早期预测疗效、降低局部复发率,还能得到和 pCR 结果较高的准确率和符合率。 4.3、PET-CT PET 检测肿瘤对化疗的敏感性,主要是以优化过程中的化疗方案来提高疗效。一般认为对 FDG 摄取的变化 SUV 下降 35% 可认为肿瘤早期代谢摄取缓解,可较好地预测 pCR 和显微镜腺癌微病灶残留的有效性。由于缺乏有效的生物靶点,直肠癌的疗效评估主要依靠影像学资料,一些学者根据 PET 的各项评估指标建立了 pCR 模型 [58],或者根据 PET 提示的肿瘤代谢体积(MV)、总病变糖酵解(TLG)[59] 等,可以作为疗效预测指标,也可指导下一步的后续治疗。但评价时间的节点仍存在过早或延迟的问题。 综上所述,肿瘤的不同生物学特性以及不同学科之间关于基础研究发现、临床试验开展的不同步,可以通过跨学科领域的沟通交流相互学习、借鉴,促进本学科肿瘤研究的进展。 |
|
|
11#
发布于:2014-11-24 16:12
参考文献详见原文下载。
表格 1. 新辅助化疗在不同癌种中的意义(对比单纯手术) 图片:20141124001.jpg 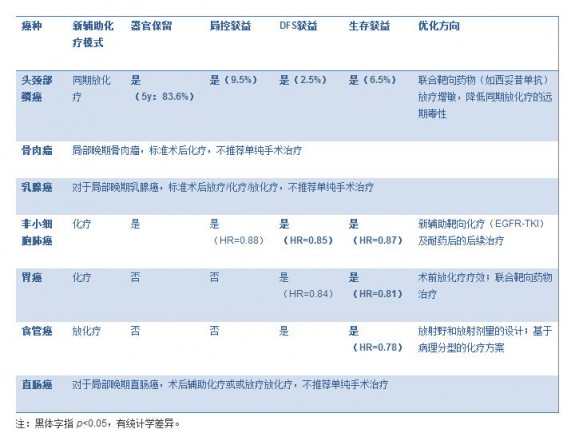
表格 2. 新辅助化疗在不同癌种中的意义(对比辅助化疗) 图片:20141124002.jpg 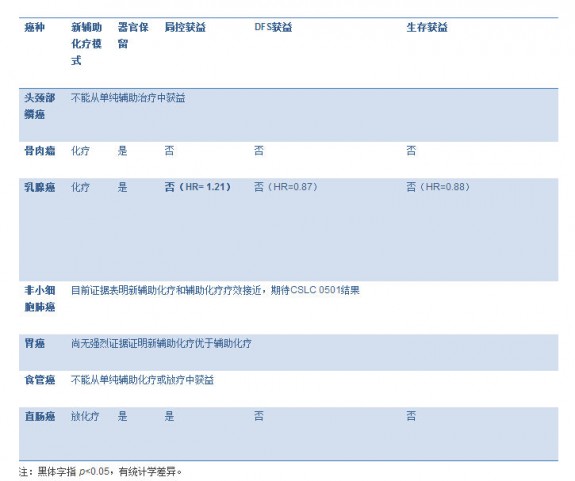
表格 3. 不同癌种的新辅助化疗疗效评估指标 图片:20141124003.jpg 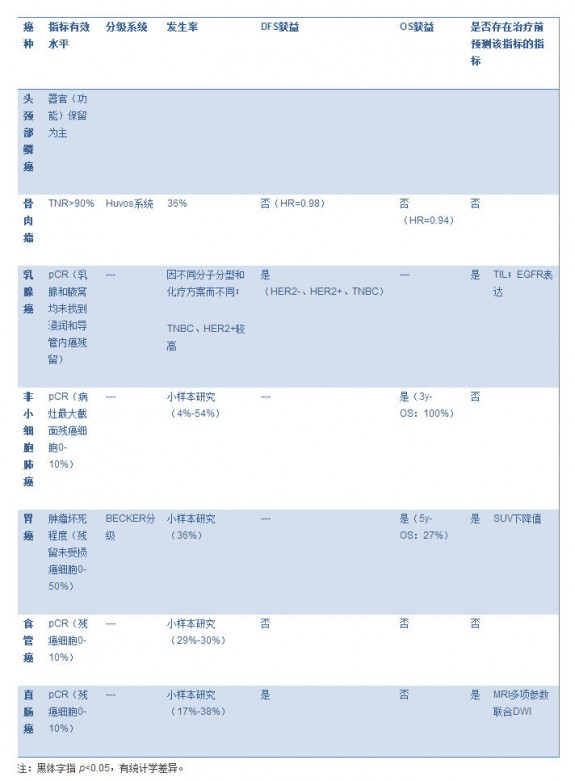
查看信源地址 |
|

